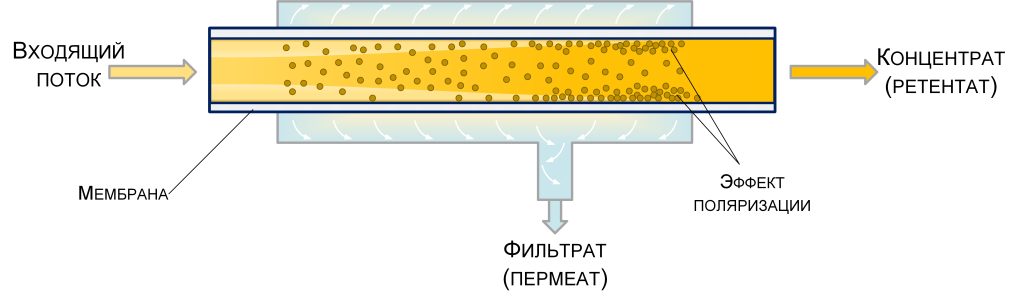
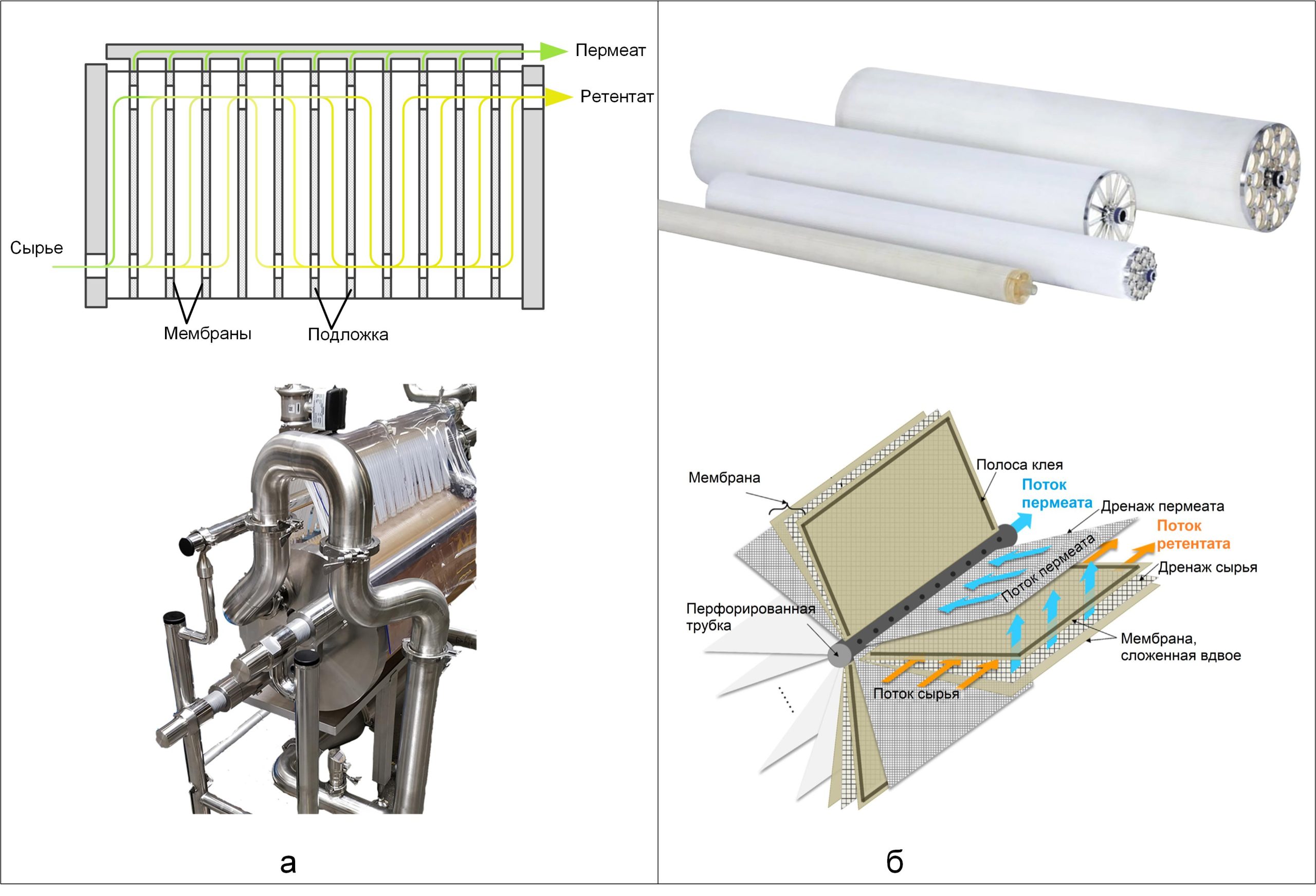
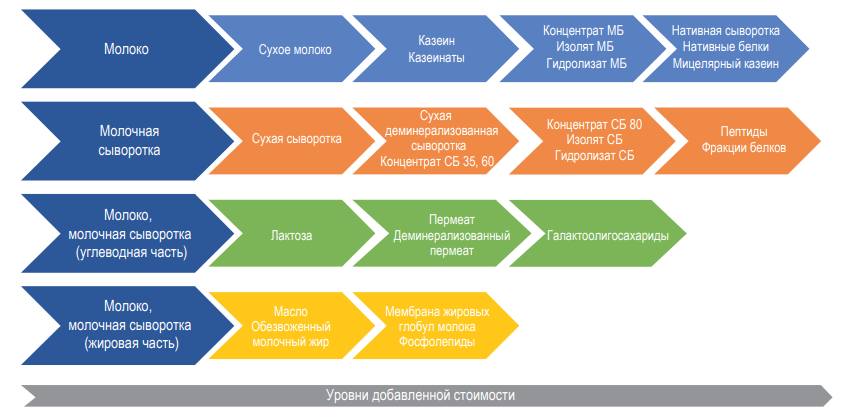
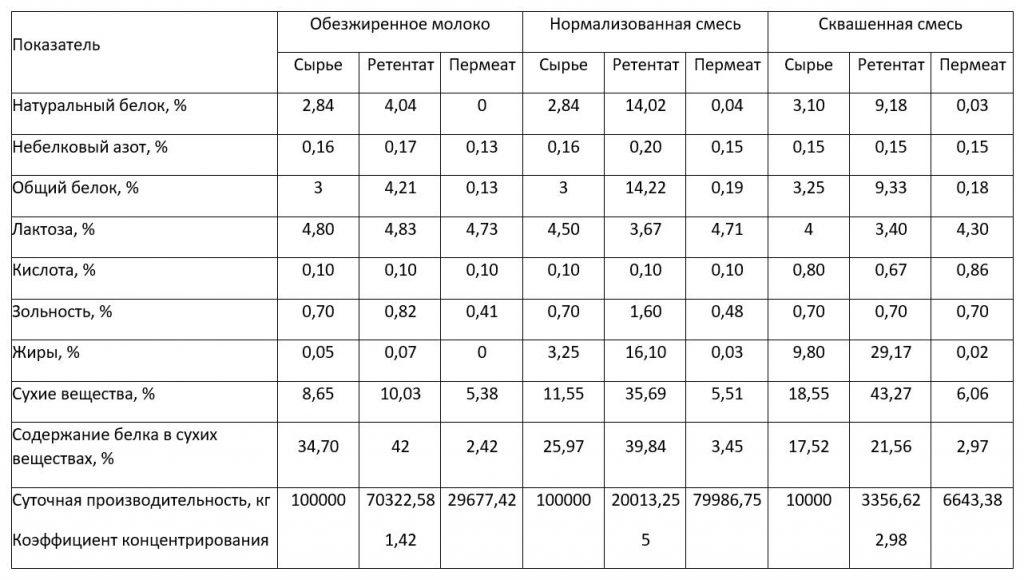
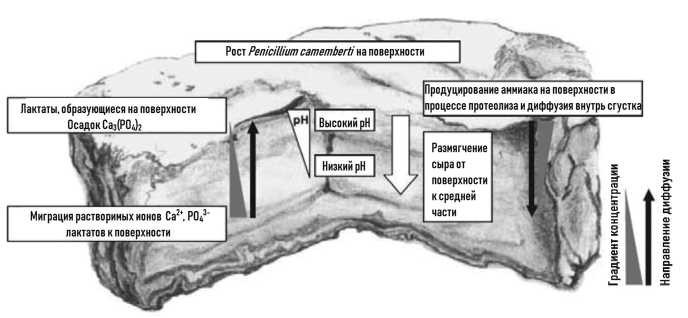
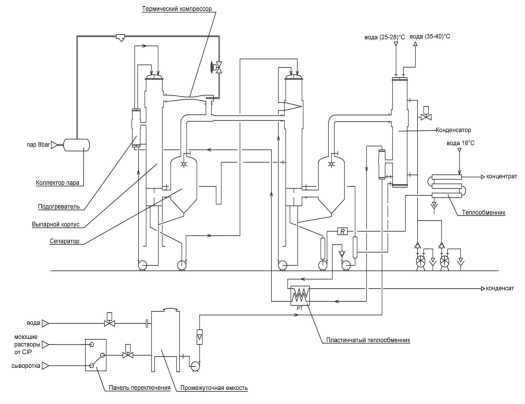
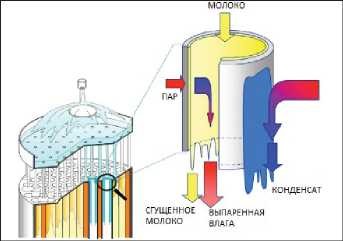
Данная статья является продолжением материала, опубликованного в №6, 2024 г [1], в котором рассматривалась казеиновая фракция белков молока, как основного компонента концентратов молочного белка (КМБ) и мицеллярного казеина (КМК).
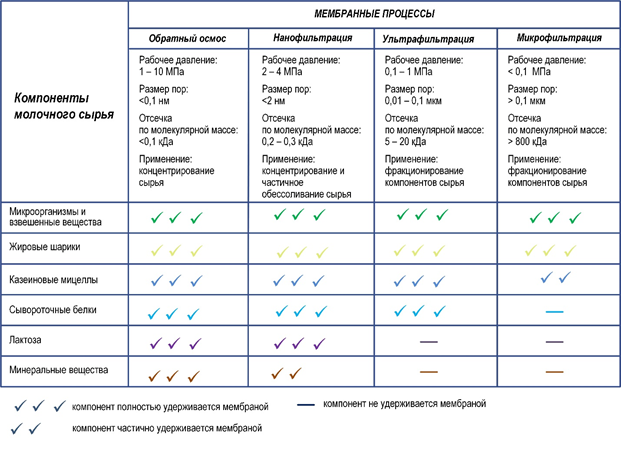
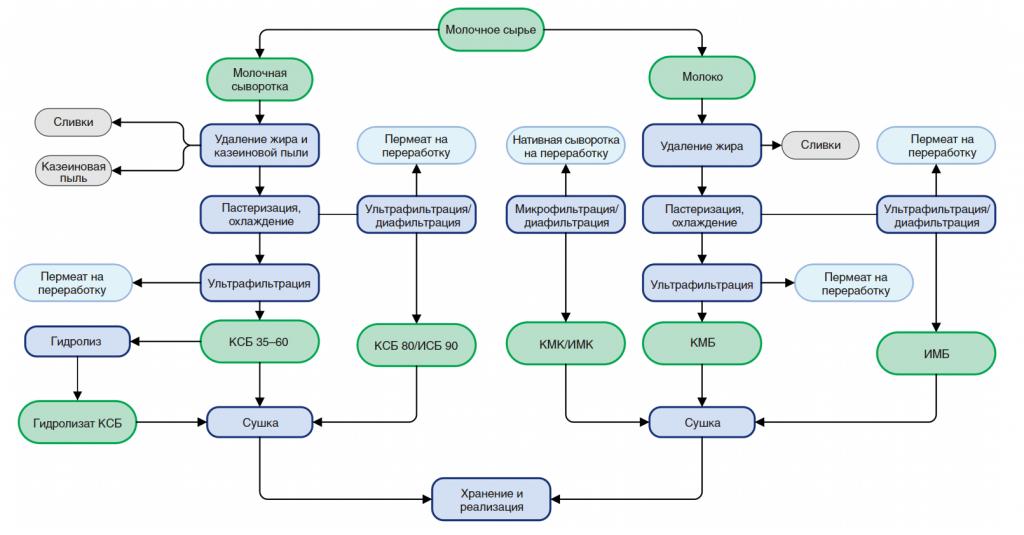
Оба продукта образуются в результате мембранного фракционирования обезжиренного молока. При этом в КМБ, получаемого при использовании ультрафильтрационной (УФ) обработки молока, концентрируются казеин, сывороточные белки и, конечно, остаточный жир [1]. Причем соотношение казеин/сывороточный белок в сырье и в КМБ одинаковое, т. к. УФ мембраны проницаемы только для низкомолекулярных компонентов молока: лактозы, минеральных веществ, небелкового азота и т.д.
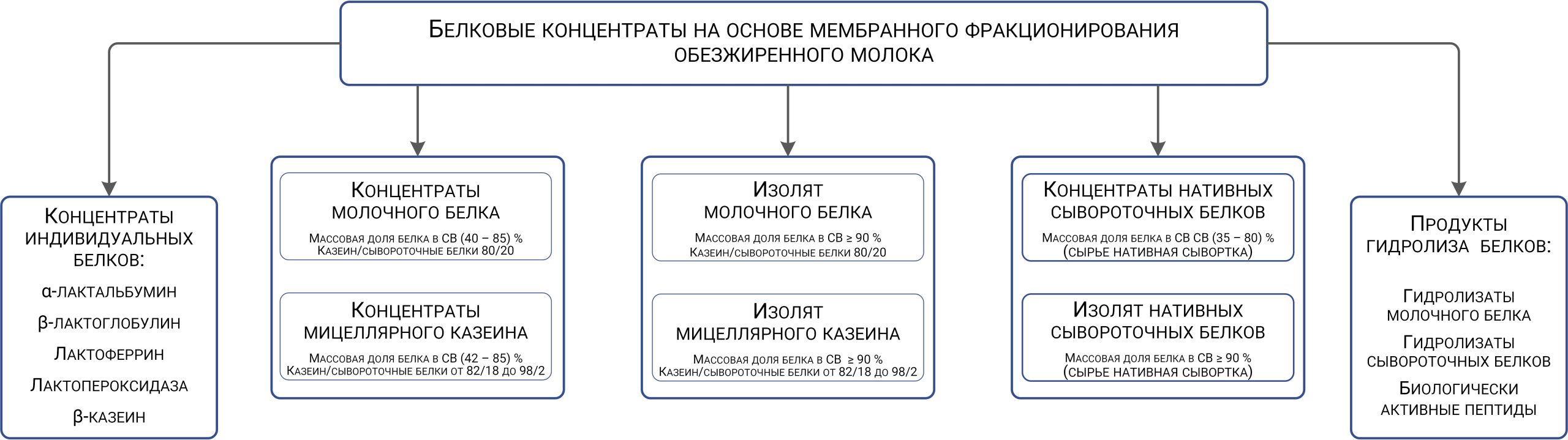
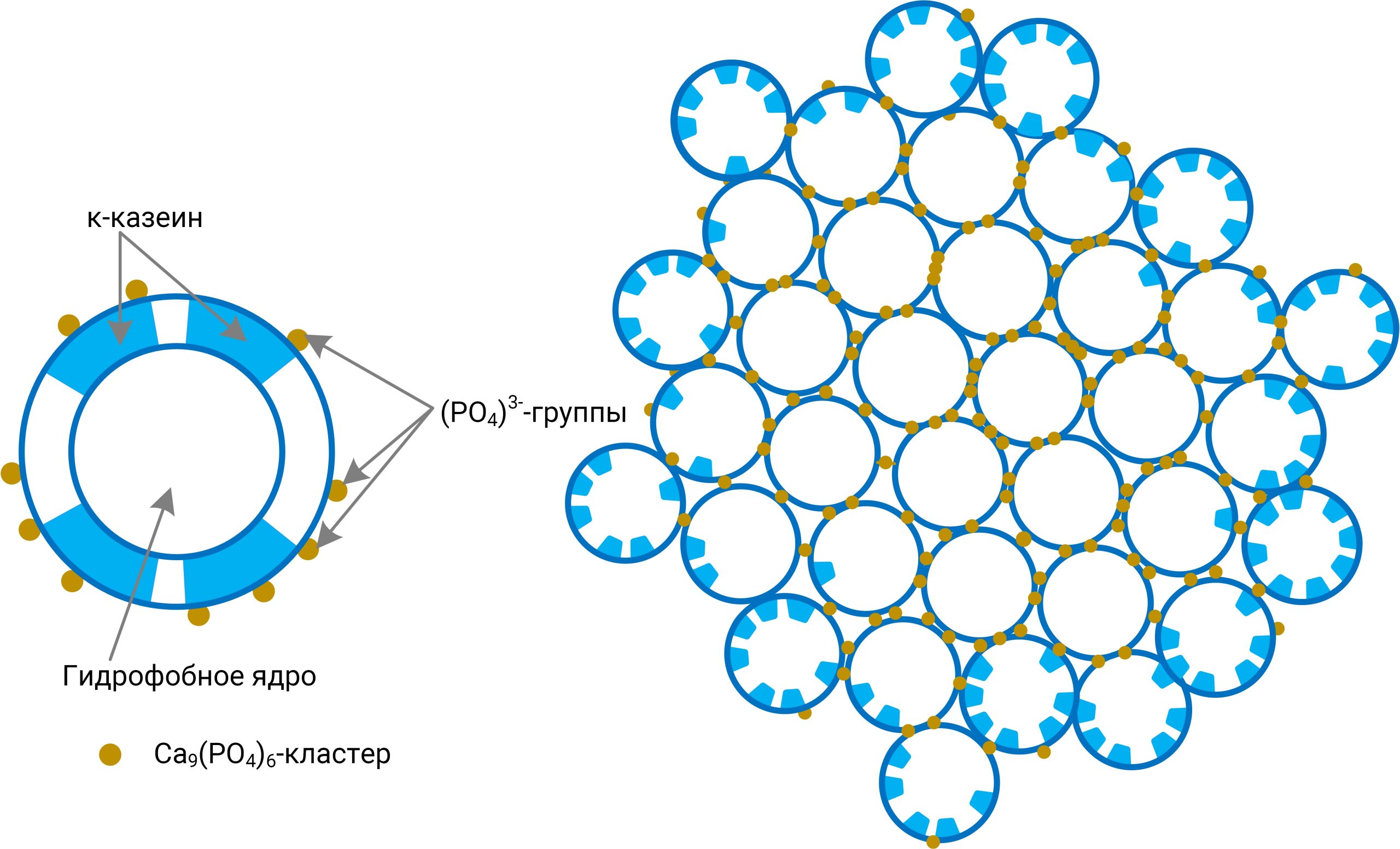
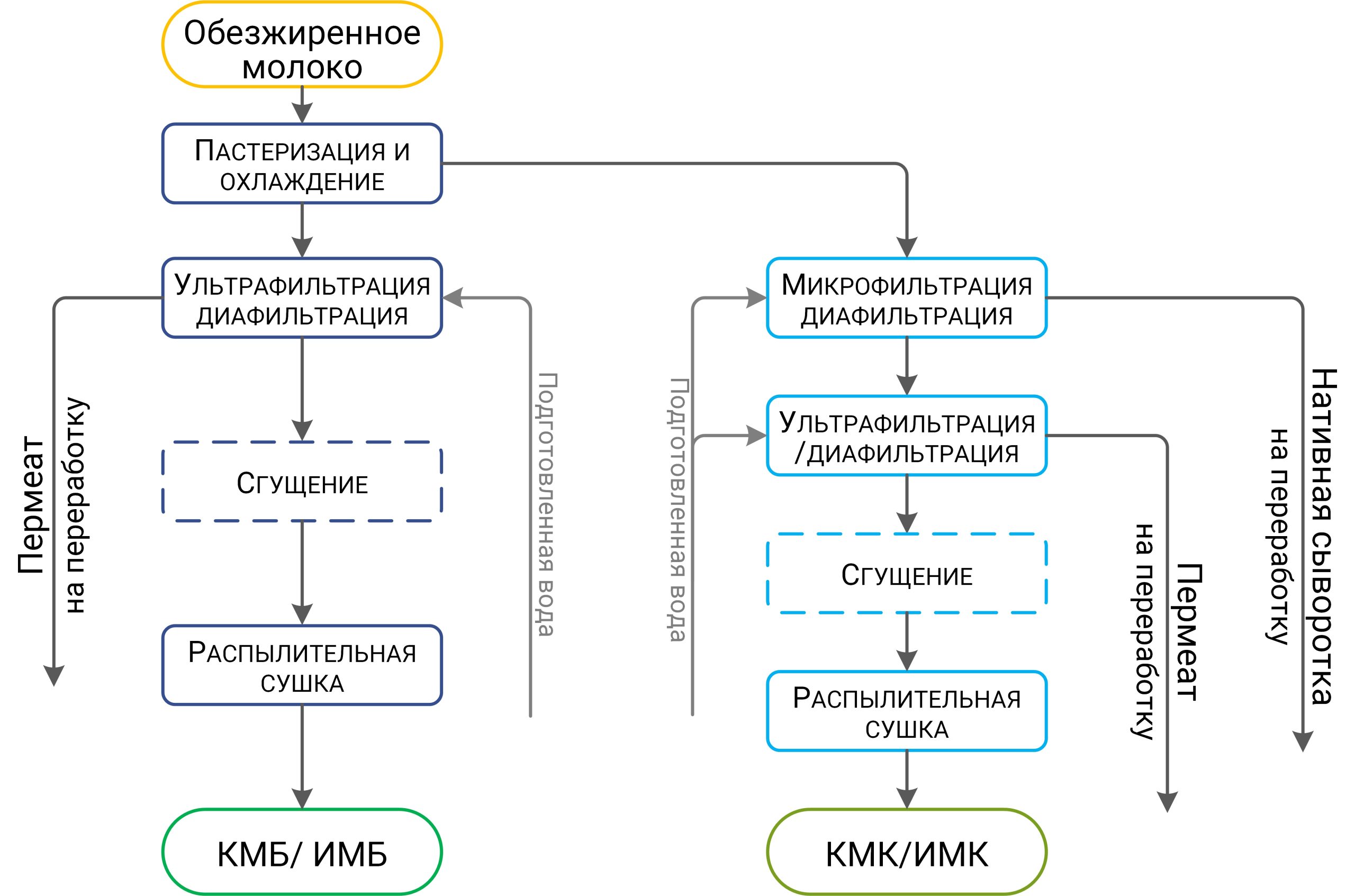
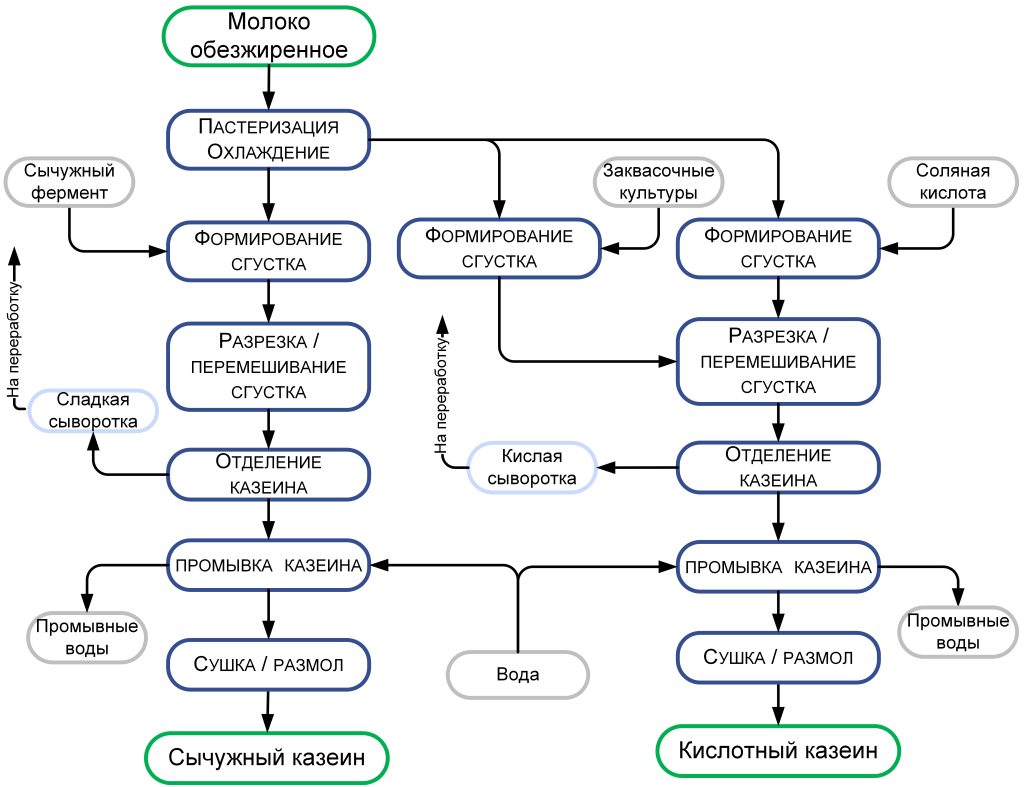
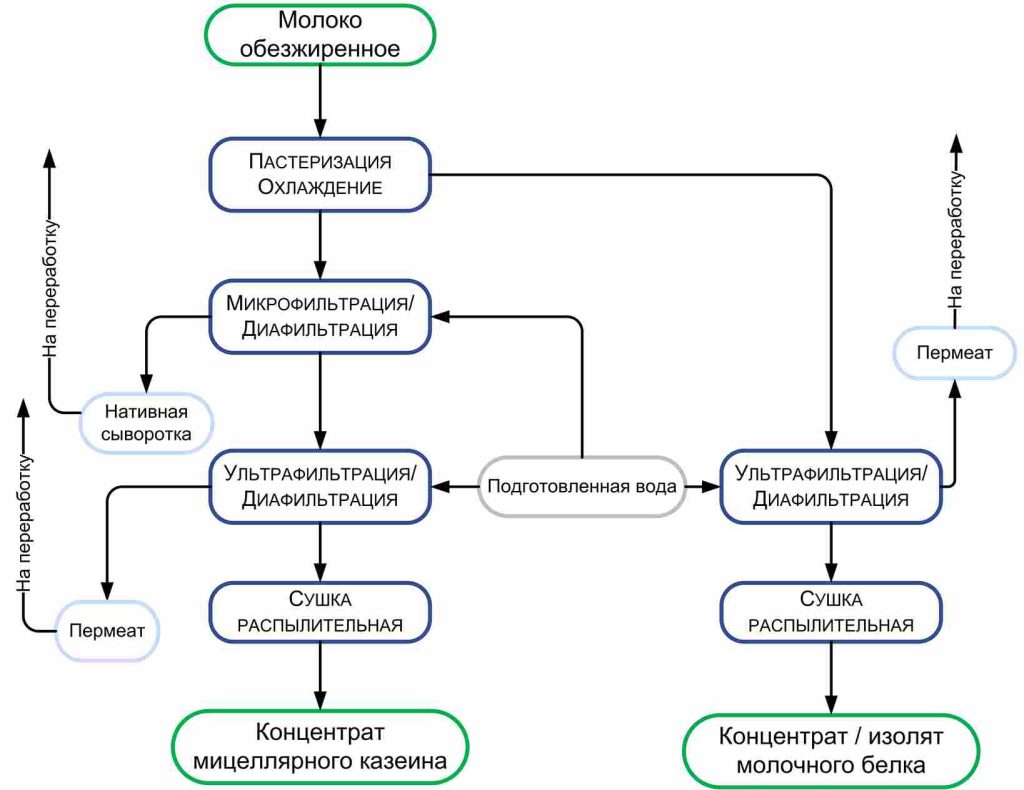
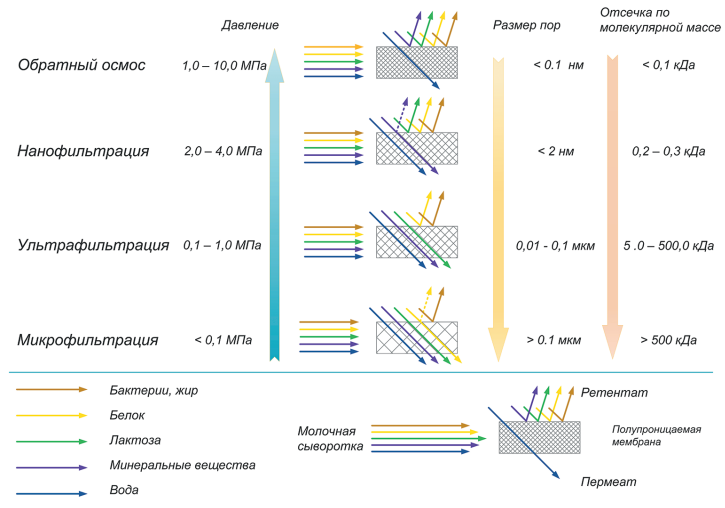
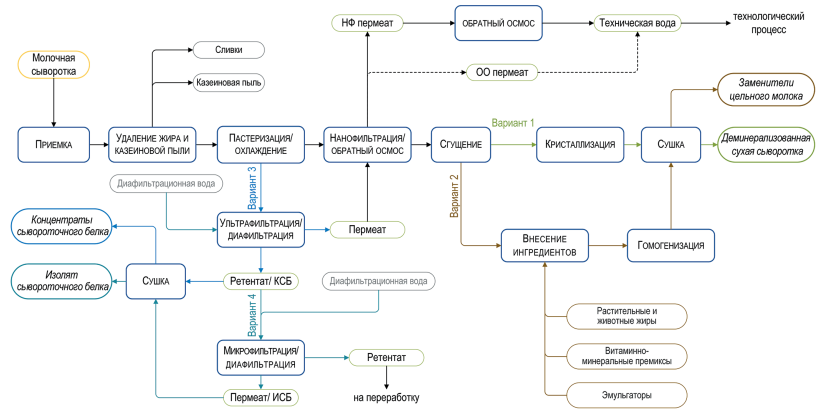
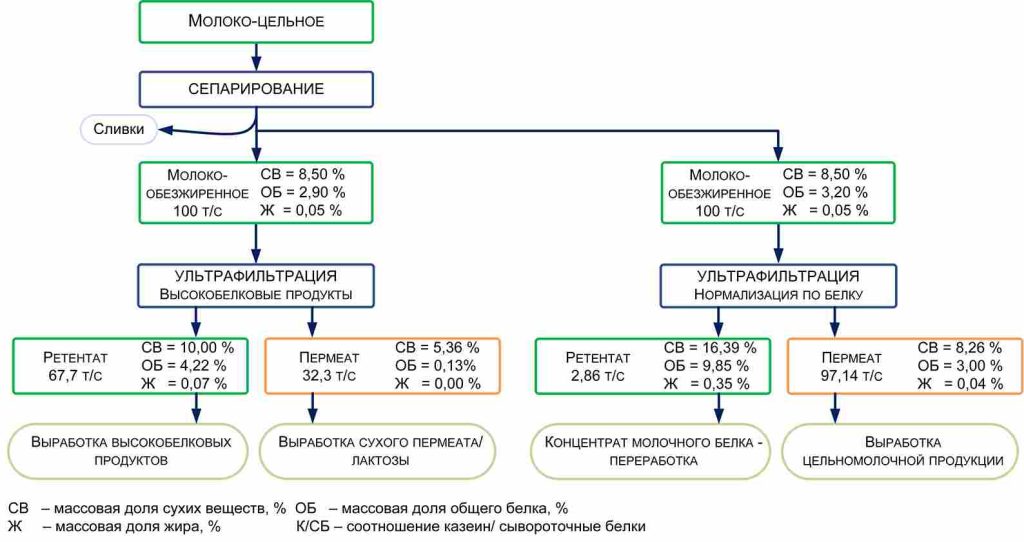
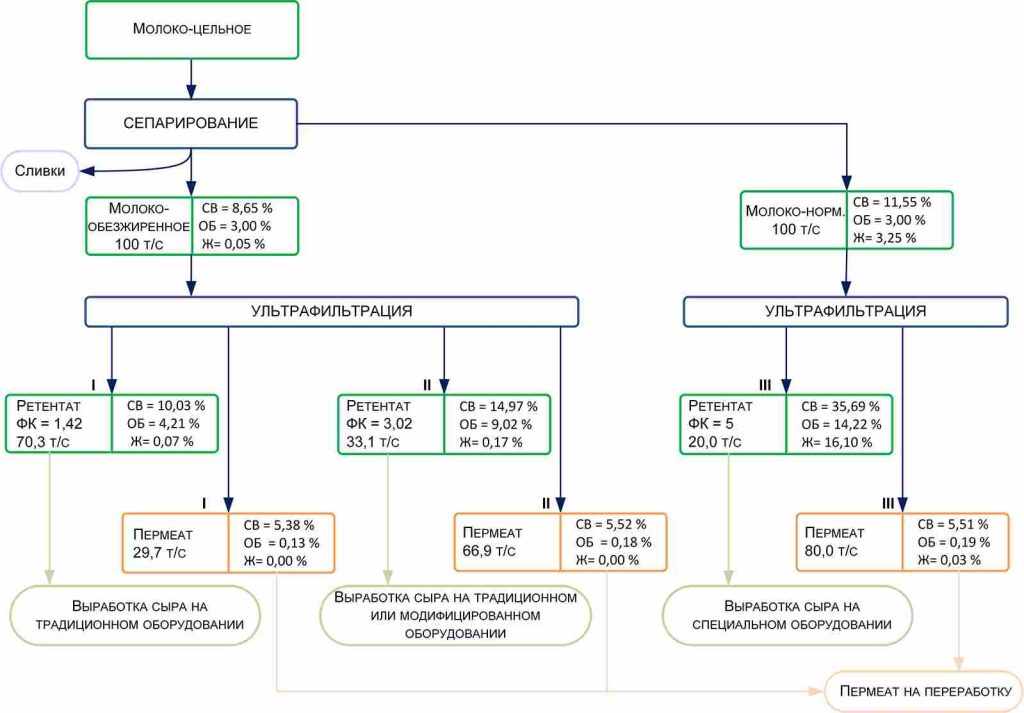
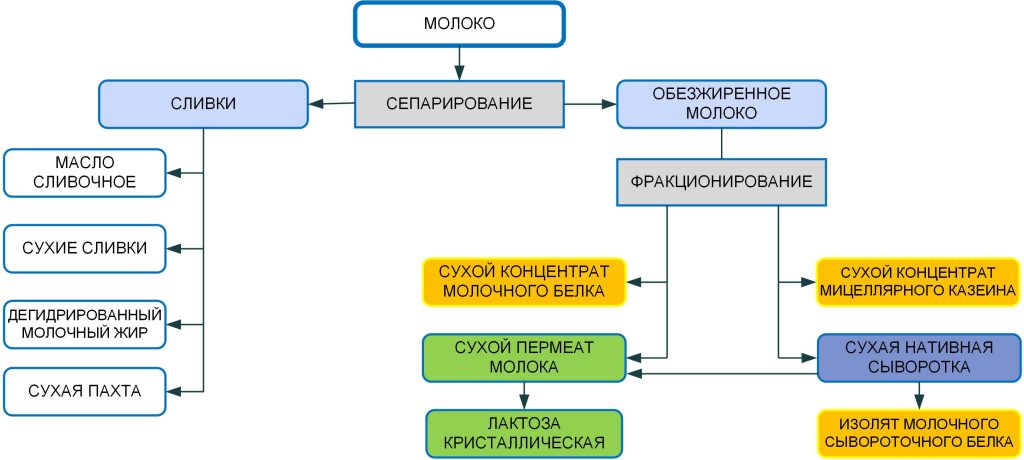
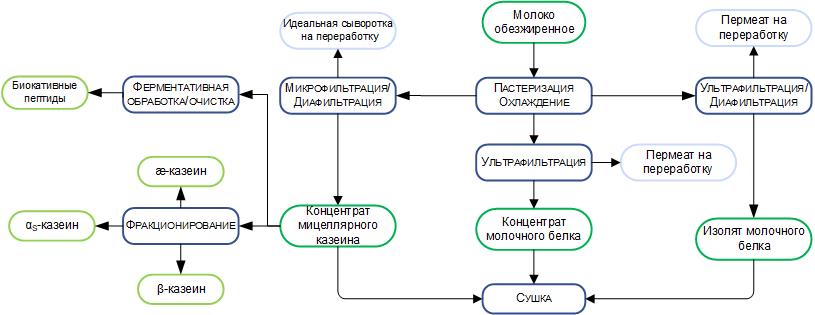
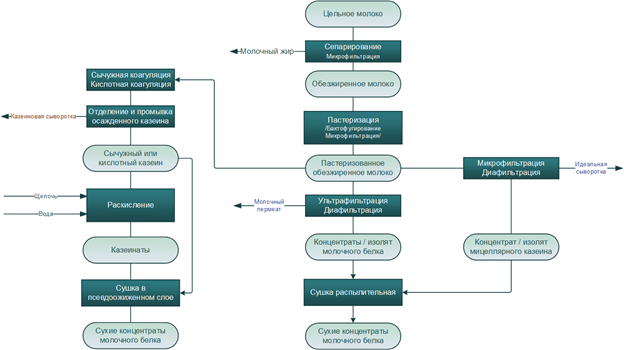
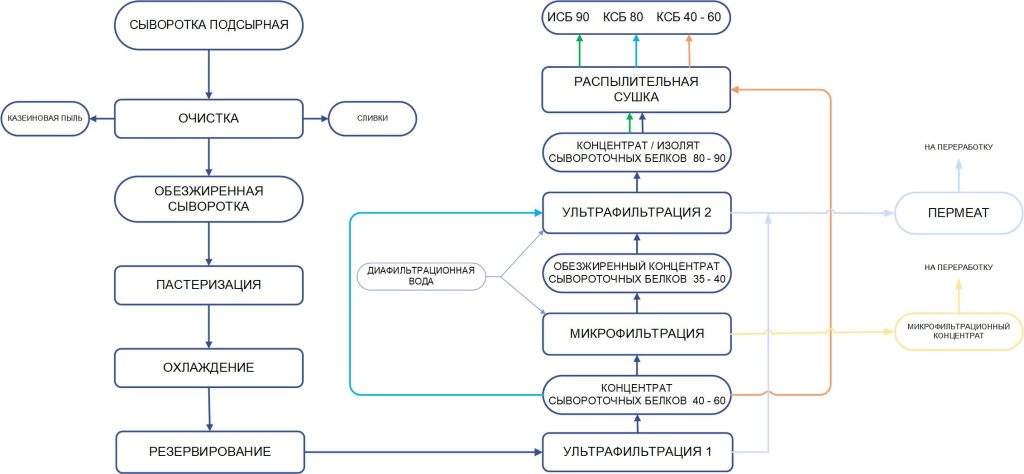
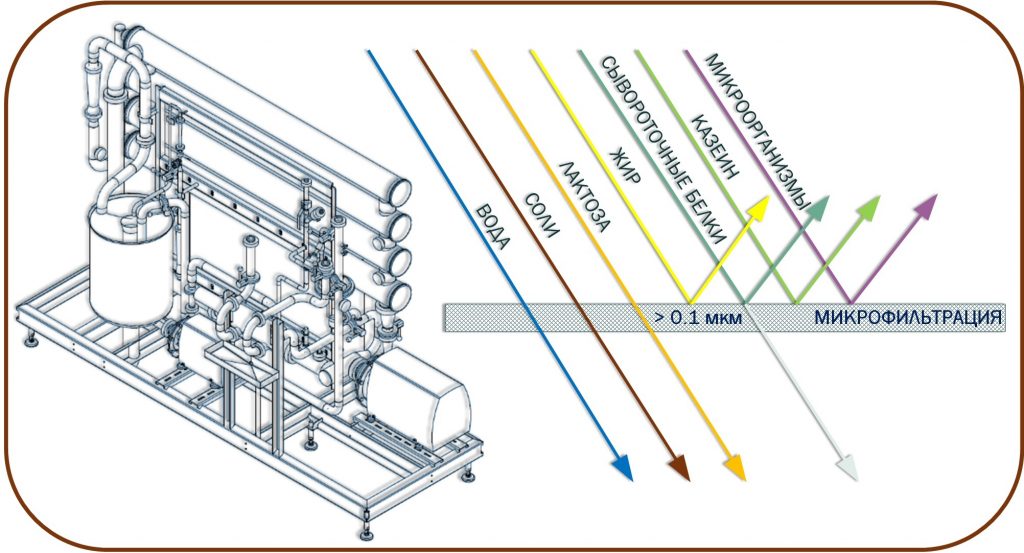
При производстве КМК (рис.1) используется микрофильтрационная (МФ) обработка. МФ мембраны удерживают в основном казеиновые мицеллы и остаточный жир, которые по размерам и молекулярной массе значительно превосходят как низкомолекулярные компоненты, так и сывороточные белки. Поэтому в КМК соотношение казеин/сывороточные белки может составлять от 90/10 и выше по отношению к казеину, что придает этому ингредиенту специфические функциональные свойства [1].
Рисунок 1 – Схема фракционирования обезжиренного молока с использованием микро- и ультрафильтрации
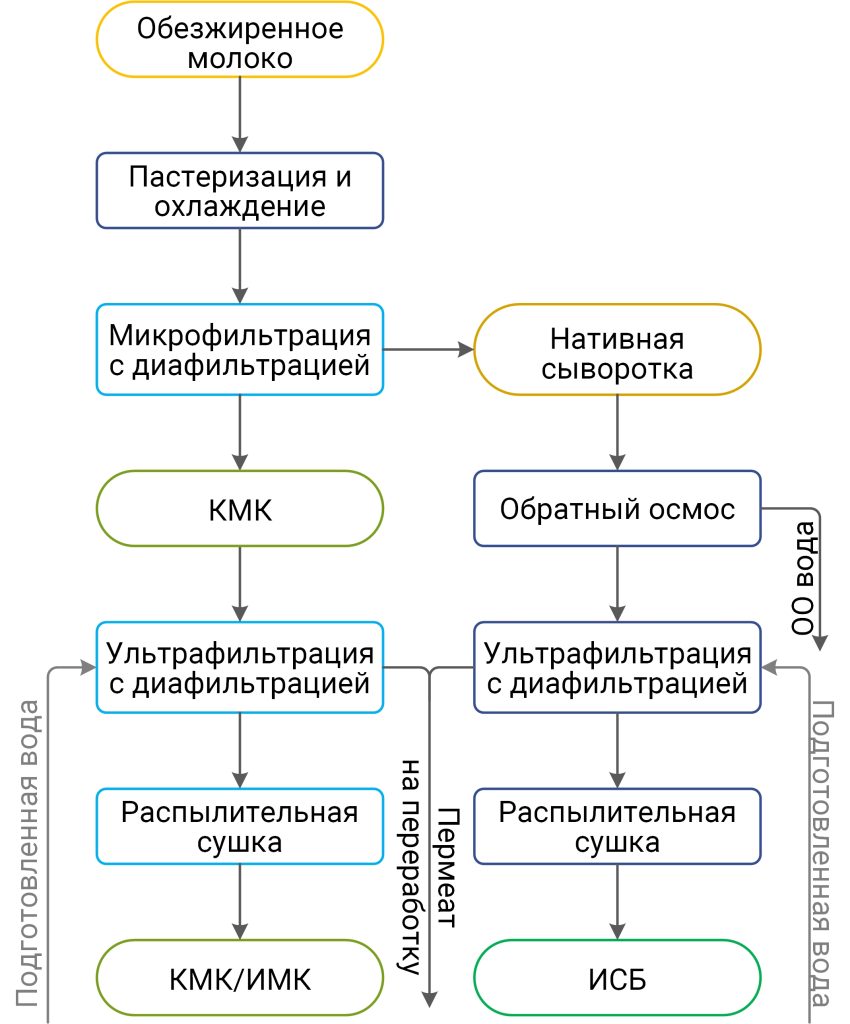
Разбавленная фракция, образующаяся после УФ обезжиренного молока – пермеат, содержит только низкомолекулярные компоненты. Хотя иногда возможно наличие в пермеате небольших количеств более крупных молекул (низкомолекулярные пептиды, протеозо-пептоны), которые могут проникать через УФ мембраны, особенно после их длительного использования [2].
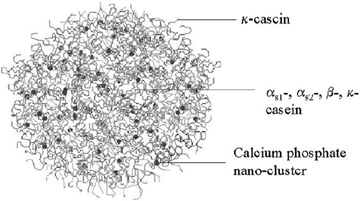
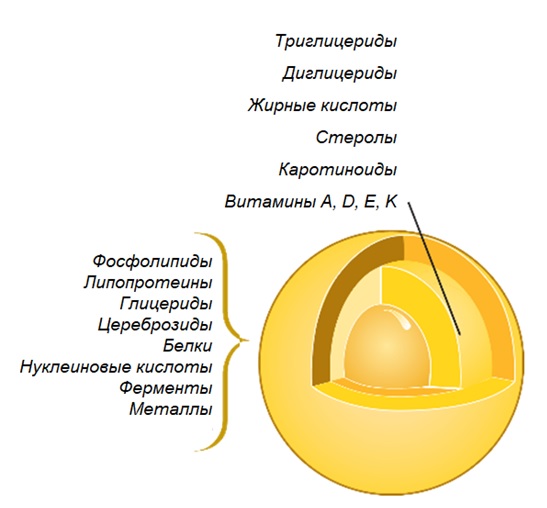
Разбавленная фракция МФ обработки обезжиренного молока (рис.1), заслуживает особого внимания. Эту фракцию называют «идеальной» или, чаще, «нативной» сывороткой [3]. Очевидно, что белковая часть нативной сыворотки представлена сывороточными белками молока, прошедшими через МФ мембрану. Сывороточные белки молока включают группу растворимых белков (рис.2), которые остаются после осаждения из молока казеина при pH 4,6 [1]. Фракционный состав сывороточных белков в значительной степени определяется происхождением молока. Так, для коровьего молока характерно преобладание β-лактоглобулина (∼65 %), α-лактальбумина (∼25 %), бычьего сывороточного альбумина (∼8 %), а также некоторыми функциональными белками, включая иммуноглобулины, лактоферрин, лактопероксидазу и др. (таблица 1).
Таблица 1 – Основные характеристики фракции сывороточных белков молока [4 — 6]
| Компонент сывороточных | Молекулярная масса (кДа) | Изоэлектрическая точка (pI) | Концентрация молоке (г/л) | Доля от сывороточных белков (%) |
| β-Лактоглобулин | 18.4 | 5.2–5.4 | 3.2–4.0 | 55–65 |
| α-Лактальбумин | 14.2 | 4.2–4.5 | 1.2–1.5 | 15–25 |
| Сывороточный альбумин (БСА) | 66.3 | 4.9 | 0.3–0.6 | ~5 |
| Иммуноглобулины | 150–900 | 5.8–7.3 | 0.6–0.9 | ~10 |
| Протеозо-пептоны | 4.1–80 | 5.1–6.0 | ~0.2 | ~10 |
| Лактоферрин | ~80 | ~8.0 | ~0.1 | <1 |
| Лактопероксидаза | ~78 | ~9.6 | ~0.03 | <1 |
β-Лактоглобулин (β-Lg, табл.1) – это глобулярный белок из семейства липокалинов, транспортных белков с характерной вторичной структурой, позволяющей осуществлять перенос небольших гидрофобных молекул, таких как ретинол, жирные кислоты и т.д. [4]. β-Lg имеет 11 генетических форм, включает 162 аминокислотных остатка (Asp10, Asn5, Thr8, Ser7, Glu16, Gln9, Pro8, Gly4, Ala15, Cys5, Val9, Met4, Ile10, Leu22, Tyr4, Phe4, Lysl5, His2, Trp2, Arg3) и характеризуется высоким содержанием аминокислот с разветвленной цепью (BCAA), в том числе и незаменимых: лейцина, изолейцина и валина [11]. Интересно, что прежде β-Lg считался уникальным компонентом молока жвачных животных, однако дальнейшие исследования показали его наличие и в молоке других видов, даже дельфинов и ламантинов. Но в грудном молоке β-Lg не обнаруживается, его основным сывороточным белком является α-лактоальбумин [5].
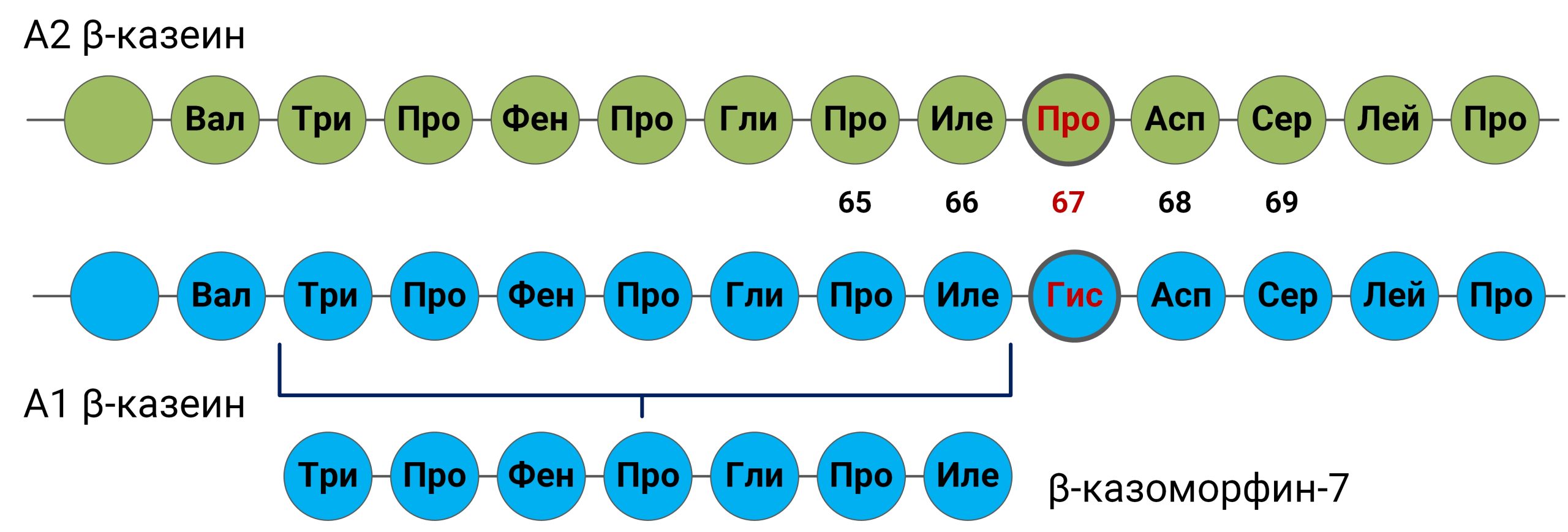
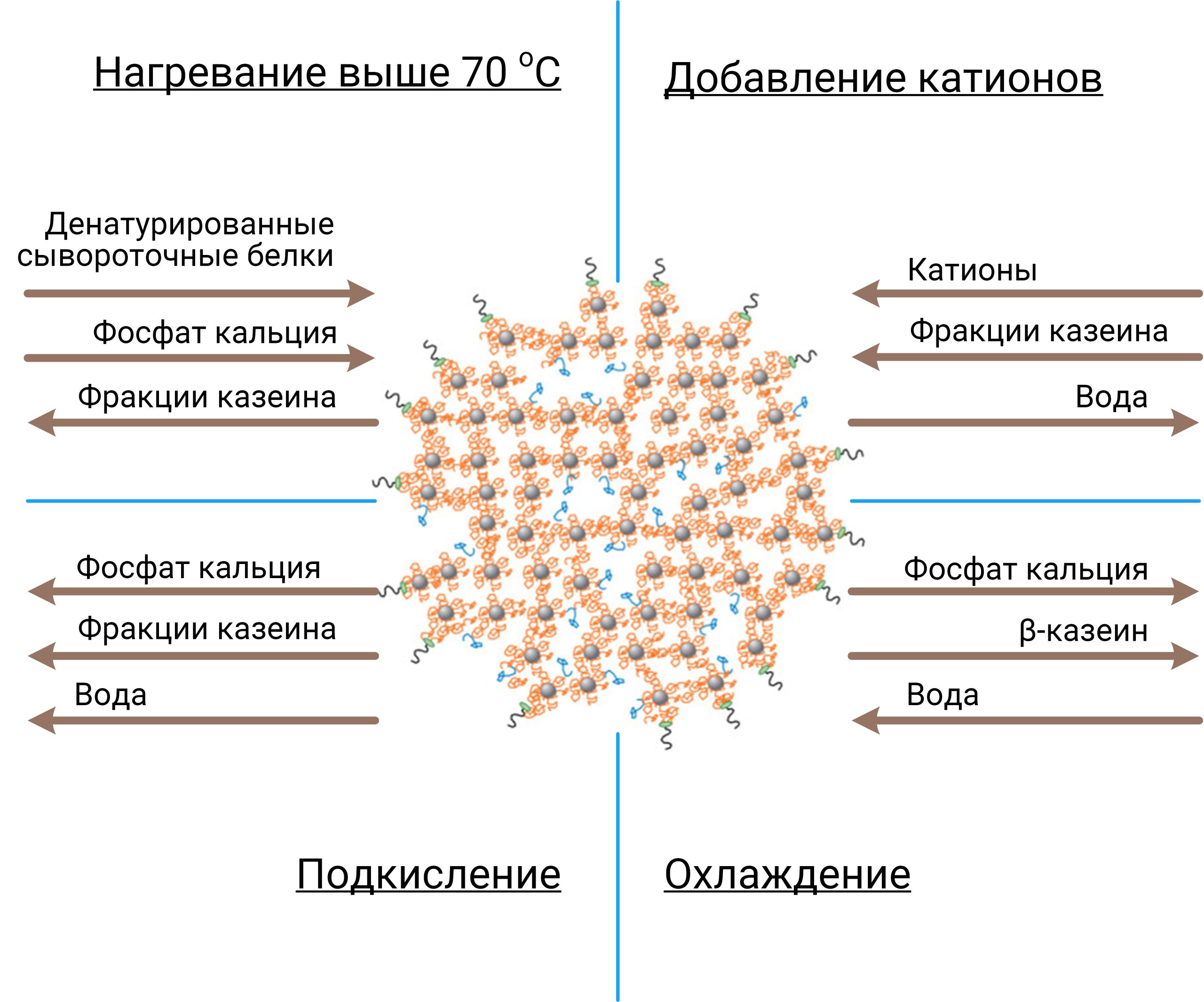
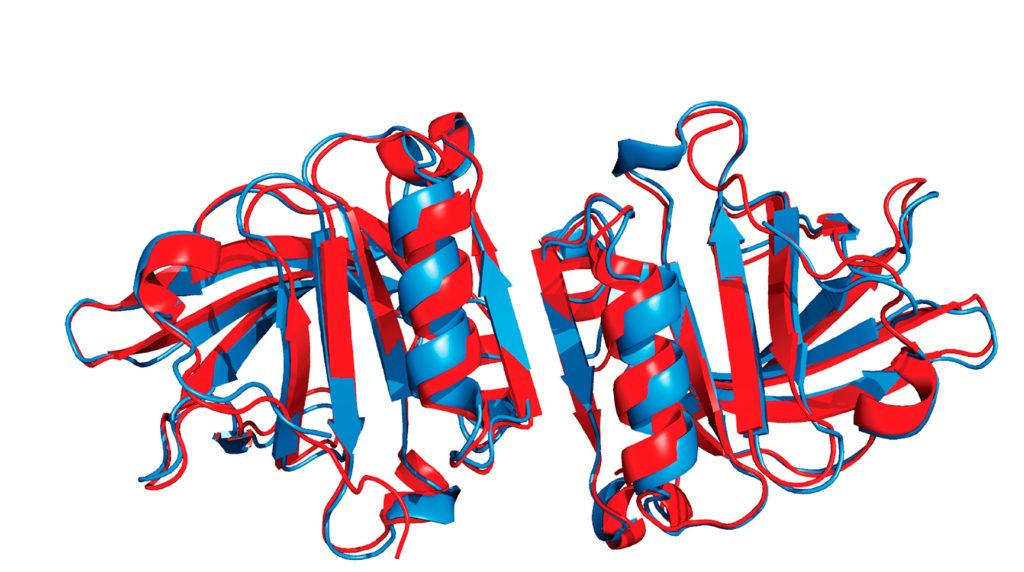
При нейтральном pH β-LG обычно существует в виде нековалентно связанного димера, который диссоциирует на мономеры при снижении pH (рис.2) [5]. Важной особенностью β-LG является наличие сульфгидрильной группы цистеина (-SH), которая в нативном состоянии расположена внутри белка. При тепловой денатурации полипептидные цепи разворачиваются, -SH группы освобождаются и могут образовывать «сшивки» с другими молекулами β-LG и межмолекулярным дисульфидом κ-казеина, что влияет на термостабильность и сычужную коагуляцию молока [6]. Кроме того, именно β-LG отвечает за формирования привкуса «перепастеризации» молока и молочных продуктов [4].
Рисунок 2 – Структура β-LG при рН 4 [12]
α-Лактоальбумин (α-La, табл. 1.) мономерный глобулярный кальций-связывающий белок, состоит из 123 аминокислотных остатков, образующих компактную глобулярную структуру, стабилизированную четырьмя дисульфидными связями: Cys6-Cys120, Cys61-Cys77, Cy73-Cys91 и Cys28-Cys111. Дисульфидные связи придают молекуле α-La относительную термическую стабильность. В отсутствии других реакционноспособных белков, например β-LG, после снятия температурной нагрузки α-La может снова образовывать структуру близкую к нативной [7]. Функциональная роль α-La заключается в том, что он является ключевым компонентом лактосинтазы, фермента, катализирующего синтез лактозы в лактирующей молочной железе. Причем количество лактозы напрямую коррелирует с количеством α-La [8]. Можно отметить, что наличие антибактериальных и иммуностимулирующих свойств [4], высокое структурное сходство α- La коровьего и грудного молока, также делает его важным ингредиентом детского питания.
Помимо α- La и β-Lg из молока в нативную сыворотку переходит ряд белков, содержащихся в низких или следовых количествах. Часть из этих белков биологически активны и могут фракционироваться из молока или сыворотки в качестве функциональных добавок. Наиболее значимым является лактоферрин — железосвязывающий гликопротеин, состоящий из одной полипептидной цепи с двумя высоко гомологичными дольками, соединёнными α-спиральной структурой. Каждая долька содержит участок связывания трёхвалентного железа. Лактоферрин имеет 16 внутримолекулярных дисульфидных связей, что обеспечивает его стабильную структуру. Он может быть полностью (холоформа) или частично насыщен железом, а также находится в апоформе. Апоформа может иметь более высокую цитотоксичность и способность к связыванию других металлов, в то время как холоформа более стабильна и эффективно связывает железо. Целевые функции лактоферрина включают антибактериальную, антиоксидантную, противовоспалительную активность, усвоение железа, защиту кишечной микрофлоры, стимуляцию иммунных клеток и др. [6].
Лактопероксидаза — это фермент, присутствующий в молоке, сыворотке и молозиве. Лактопероксидаза представляет собой гликопротеин с одной полипептидной цепью из 612 аминокислот, имеет две основные формы, A и B, из-за различий в дезаминировании остатков глутамина и аспарагина; вместе с вариациями углеводных цепей она существует в общей сложности в 10 вариантах. Лактопероксидаза катализирует реакцию окисления ионов галогенов (таких как йодид, бромид и тиоцианат) пероксидом водорода, образуя гипогалогениды, которые обладают бактерицидными свойствами. Эти соединения способны инактивировать бактерии, грибы и вирусы. В коровьем молоке она является вторым по распространённости ферментом после ксантиноксидазы, которая связана с мембраной жировых шариков молока [6].
Лактоферрин и лактопероксидаза являются белками, выделяемыми в промышленном масштабе из обезжиренного молока и подсырной сыворотки.
Бычий сывороточный альбумин (БСА) содержит 583 аминокислоты, не содержит фосфора, имеет 17 дисульфидных связей и 1 свободную сульфгидрильную группу. БСА является многофункциональным белком с исключительной способностью связывать лиганды, особенно жирные кислоты, ароматические соединения, ионы металлов и обеспечивать транспорт биологически активных веществ. Кроме того, БСА, связывая токсические продукты жизнедеятельности и ионы тяжелых металлов, способствует их транспортировке в органы выделения, что снижает негативное воздействие токсинов на организм [7, 8].
Иммуноглобулины – сложные белки, вырабатываемые β – лимфоцитами, которые поддерживают белковый баланс в сыворотке крови и выполняют ключевую функцию в иммунной системе, особенно в молозиве, а также играют важнейшую роль в иммунной системе, обеспечивая защиту новорожденных от патогенов [9]. Помимо иммуноглобулинов в нативной сыворотке обнаружены биологически активные пептиды молока, протеозопептонная фракция и т.д.
В целом, состав белков нативной, творожной и подсырной сыворотки идентичен. Но для белковой фракции нативной сыворотки характерно высокое содержание аминокислот с разветвленной цепью (примерно 50% из которых составляет лейцин) c быстрой скоростью усвоения [10]. Кроме того, нативная сыворотка не содержит гликомакропептид и другие метаболиты, образующиеся под действием сычужного фермента и заквасочной микрофлоры, что улучшает функциональные свойства белковых ингредиентов на ее основе [9].
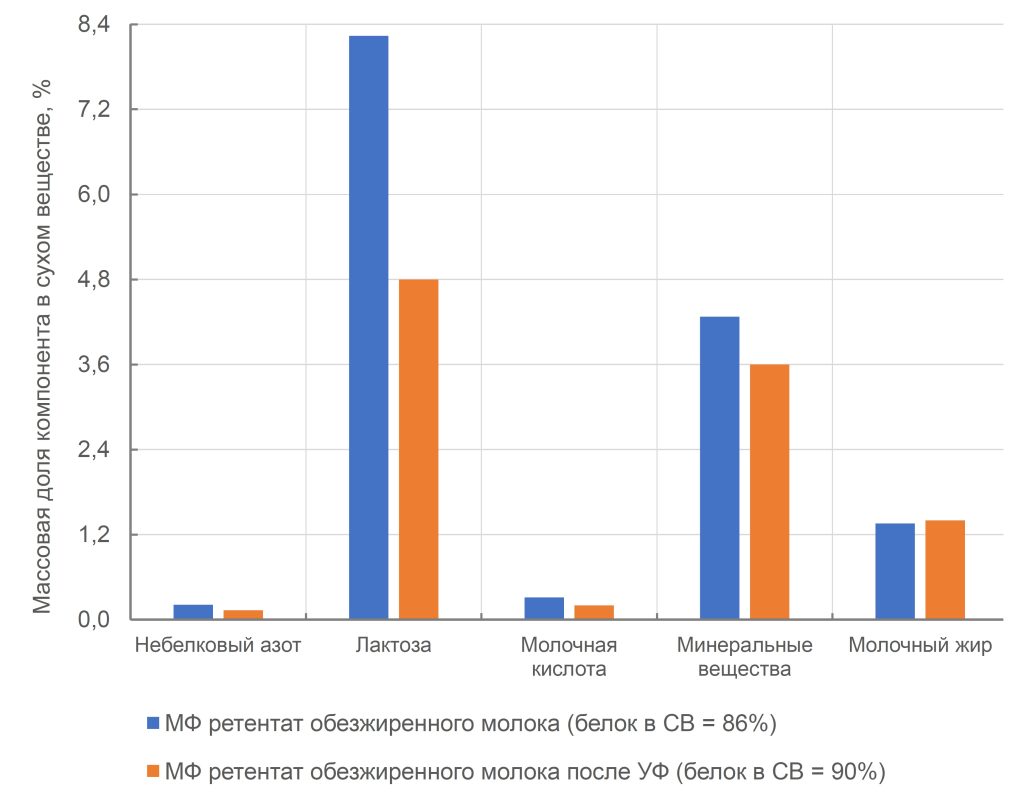
С технологической точки зрения нативная сыворотка является идеальным сырьем для получения концентратов сывороточного белка, т. к. при МФ обезжиренного молока остаточная жировая фракция и остаточная микрофлора практически полностью задерживаются МФ мембраной. Именно поэтому УФ обработка нативной сыворотки в сочетании с диафильтрацией (рис.1) позволяет получать продукт – нативный концентрат/ изолят сывороточных белков (нКСБ/ нИСБ), состав которого приближается к составу изолятов сывороточного белка (рис.3).
Рисунок 3 – Сравнение состава сухого остатка КСБ 80, ИСБ 90, нКСБ (ИСБ)
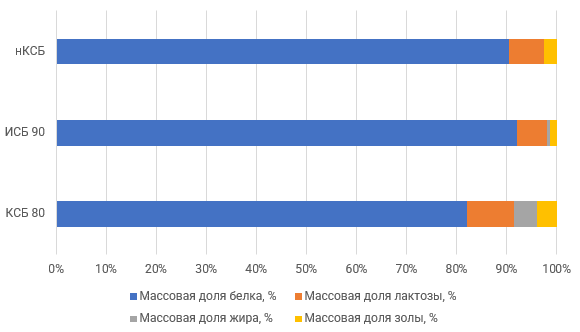
По функционально-технологическим характеристикам нКСБ превосходят традиционные концентраты сывороточных белков: они демонстрируют большую прочность геля, лучшие пенообразующие, эмульгирующие и влагоудерживающие свойства, обеспечивают возможность создания прозрачных белковых напитков при различных значениях pH. Как и классические КСБ, нКСБ применяется в производстве спортивных напитков, протеиновых батончиков, детских смесей и других продуктов. Однако их ключевое преимущество — повышенная чистота состава и отсутствие вторичных продуктов переработки — делает их более предпочтительными для использования, особенно в сегменте детского питания, где требования к качеству и безопасности наиболее строгие.
Таким образом, мембранная технология фракционирования обезжиренного молока, основанная на комбинации микрофильтрации, ультрафильтрации и диафильтрации, позволяет селективно разделять белковые компоненты молока, что обеспечивает возможность получения сухих ингредиентов на основе казеиновой фракции и фракции сывороточных белков. При этом гибкость процессов мембранной фильтрации позволяет регулировать состав конечного продукта путем изменения параметров работы мембранного оборудования. Реализованные ООО «ДМП» проекты производства сухих молочных ингредиентов демонстрируют перспективность технологии для российских производителей в условиях импортозамещения, благодаря возможности создания продуктов с заданными функциональными свойствами.
Список литературы
- Володин Д. Н., Топалов В. К., Куликова И. К., Евдокимов И. А., Сорокин К. Ю. Мембранное фракционирование обезжиренного молока: влияние казеина на формирование функциональных свойств белковых концентратов // Молочная промышленность. 2024. №. 6. С. 48-53.
- Евдокимов И.А., Топалов В.К. Особенности использования полимерных мембран в процессе мембранного фракционирования молочного сырья // Переработка молока. 2024. №. 2.
- Евдокимов И.А., Топалов В.К., Володин Д. Н. Возможности интеграции мембранных технологий в комплексные линии переработки молока // Переработка молока. 2021. №. 11.
- Zhang, F., Qi, X., Zou, M., & Li, J. (2012). Analysis of alphalactalbumin and betalactoglobulin from the rehydration of bovine colostrum powder using cloud point extraction and mass spectrometry. Journal of analytical methods in chemistry, 2012, 816180. https://doi.org/10.1155/2012/816180
- Sawyer, L. (2012). Β-Lactoglobulin. In Springer eBooks (pp. 211–259). https://doi.org/10.1007/978-1-4614-4714-6_7
- Goulding, D., Fox, P., & O’Mahony, J. (2020). Milk proteins: An overview. In Elsevier eBooks (pp. 21–98). https://doi.org/10.1016/b978-0-12-815251-5.00002-5
- Deeth, H., & Bansal, N. (2018). Whey proteins. In Elsevier eBooks (pp. 1–50). https://doi.org/10.1016/b978-0-12-812124-5.00001-1
- Nicoleta, Stănciuc & Rapeanu, Gabriela. (2010). An overview of bovine α-lactalbumin structure and functionality. Annals of the University Dunarea de Jos of Galati. Fascicle VI : Food Technology. 34.
- Korhonen, H.J., and P. Marnila. “Bovine milk immunoglobulins against microbial human diseases.” Dairy-Derived Ingredients (2009): 269–289. doi:10.1533/9781845697198.2.269
- Hamarsland H, Nordengen AL, Nyvik Aas S, Holte K, Garthe I, Paulsen G, Cotter M, Børsheim E, Benestad HB, Raastad T. Native whey protein with high levels of leucine results in similar post-exercise muscular anabolic responses as regular whey protein: a randomized controlled trial. J Int Soc Sports Nutr. 2017 Nov 21;14:43. doi: 10.1186/s12970-017-0202-y. PMID: 29200982; PMCID: PMC5697397.
- Ельчанинов В.В., El’chaninov V.V. Номенклатура и биохимические свойства основных сывороточных белков. Бета-лактоглобулин // Сыроделие и маслоделие. — 2009. — №2. — C. 38-39.
- Khan S., Ipsen R., Almdal K., Svensson B., Harris P. Revealing the Dimeric Crystal and Solution Structure of β-Lactoglobulin at pH 4 and Its pH and Salt Dependent Monomer–Dimer Equilibrium. // Biomacromolecules. — 2018. – I.19. V.7. – P. 2905 – 2912. DOI: 10.1021/acs.biomac.8b00471